本栏目由医隆网专家团队审核!
自从1946年瑞典物理化学家Tiselius教授研制的第一台商品化移界电泳系统问世以来,在近半个多世纪的时间里,电泳分析所用仪器发展迅速。 特别是电泳所用支持介质由流动相改为固相支持物后,各种各样的电泳分析装置不断推出以适应临床、科研和教学工作的需要。 直至20世纪60 年代,电泳仍处于纯手工操作时期,主要以醋酸纤维素薄膜(简称醋纤膜)作为电泳支持介质,且没有专用的电泳扫描仪作为分析工具,条带的分析通常使用脱色比色法。 即只能在电泳分离、染色后,用手工方法将各种电泳条带分别剪下,放入不同试管中,再用适当溶液将染料溶解脱色,最后放入比色计中比色,测定各种成分的吸光度,然后计算出各种成分所占百分比及浓度。 这一方法操作复杂,干扰因素多。 从20世纪60年代开始,随着琼脂糖凝胶作为电泳支持介质的广泛应用,使得以往用醋纤膜电泳无法分离的成分或无法检测出的成分得以分离或检测,分离效果及灵敏度大为改善。 随后,电泳操作逐渐自动化,主要体现在将原先对实验结果影响较大的胶片制作和缓冲液的配制实现自动化,电泳条件的固定,由仪器自动控制电泳过程、染脱色过程、干燥过程及扫描成像过程。 这些步骤的自动化,消除了人员操作差异引起的结果误差,使得电泳技术能广泛用于检验医学领域。
市场上最先出现的自动化电泳仪是自动醋纤膜电泳仪,使用醋纤膜电泳片作为电泳支持介质,自动化程度高,只需将样品、试剂、电泳片放置好,人员即可离机完成实验得到结果。 但是醋纤膜灵敏度低,只能简单用于血清蛋白电泳分析,同工酶分析效果也不理想,更无法分析尿蛋白和脑脊液蛋白,在临床检验中的使用受到很大限制。 这类基于醋纤膜为介质的电泳分析系统后来逐渐被琼脂糖凝胶为介质的自动化琼脂糖电泳所替代。
使用自动化琼脂糖电泳仪,需提供预先制备好的缓冲液海绵条以及琼脂糖胶片,仪器内设定好的针对不同蛋白分离的电泳条件,自动点样、电泳、染脱色以及烘干胶片,减少了人为操作引起的误差。
这一自动化引起了电泳业的革命,且琼脂糖凝胶电泳胶片灵敏度高,可开展项目多,为许多实验室所接受,目前在检验医学临床实验室使用较为广泛。具有代表性的产品有法国Sebia公司的HYDRASYS系列和美国Helena公司的SPIFE 系列。
在琼脂糖电泳仪自动化程度不断提高的历史进程中,出现了一种崭新的电泳技术———毛细管电泳,它的发展历史可以追溯到20世纪60年代中期,瑞典科学家Hjerten 首先用内径为3mm的石英毛细管进行了电泳分离。 从20世纪80年代初开始,毛细管电泳技术开始了突飞猛进的发展,1989年Beckman 公司P/ ACE 高效毛细管电泳仪诞生。1997年Beckman/ coulter公司P / ACE MDQ 系列产品出现。 而直到21世纪初才开始真正应用到临床检验。 目前在临床上主要用于蛋白质分析和核酸分析。 毛细管电泳仪是目前市场上两类主流电泳仪之一。
电泳的分类随电泳技术的发展而不断细化,从早期的支持物分类,到后来根据主要设备特点和分离原理分类有很多种,每一种命名都有其片面性,不能包含所有电泳技术,以下列举了常见的一些分类。
(1) 根据工作原理的不同,可分为移界电泳、区带电泳、等速电泳、等电聚焦电泳、免疫电泳等。
(2) 根据有无固体支持物分类
1) 自由电泳:不需要支持物的电泳,包括 Tiseleas 式微量电泳、显微电泳、等电聚焦电泳、等速电泳和密度梯度电泳等。
2) 支持物电泳:需要支持物的电泳;支持物的种类很多,现在还在用的支持物的种类有纸、醋酸纤维膜、各种凝胶(琼脂或聚丙烯酰胺以及明胶等)。 琼脂凝胶孔径比较大,不适合蛋白分离,但能用于同工酶(含亚型)和大分子核酸分离;聚丙烯酰胺凝胶适合分离蛋白和小分子核酸;醋酸纤维膜适合血清蛋白电泳。
(3) 根据支持载体的位置或形状可分成:水平电泳、垂直电泳、板状电泳、柱状电泳、U 形管电泳、倒“V”形电泳、毛细管电泳等。
(4) 根据电源控制的不同,一般可分为以下3 类。
1) 恒压电泳:包括超高压( >5000V)、高压(1500~5000V)、中压( 500~1500V) 和低压(<500V)。
2) 恒流电泳:包括大电流( >0.5A)、中电流(0.1~0.5A)和小电流(<0.1A)。
3) 恒功率电泳:包括大功率(>200W)、中功率(60~200W)和小功率(<60W)。
(5) 根据自动化程度的不同,可分为手工、半自动和全自动型。
(6) 根据功能不同分类
1) 制备型:用于分析物中特定属性组分的制备,主要有制备型等电聚焦电泳。
2) 分析型:用于样本的组分分离和鉴定,常见的电泳多是分析型电泳。
3) 转移型:用于样本中组分从一个支持物转移到另一支持物的电泳,根据转移方式又分为湿转和半干转等。 两者的原理完全相同,只是用于固定胶/ 膜叠层和施加电场的机械装置不同。 湿转是一种传统方法,将胶/ 膜叠层浸入缓冲液槽然后加电压。 这是一种有效方法但比较慢,需要大体积缓冲液且只能用一种缓冲液。 半干转移,用浸透缓冲液的多层滤纸代替缓冲液槽。 因为电极板直接与滤纸接触,使凝胶中电场强度尽可能地以快速高效转移。 与湿转相比,这种方法又快(15~45min)又好。多数半干转移方法使用一种以上的缓冲系统,可以同时高效转移大小不同的蛋白。
4)浓缩型:通过电泳技术对样本中待分析组分进行浓缩,以提高检测灵敏度。 常见浓缩电泳方法有SDS-PAGE电泳中所用浓缩胶、毛细管电泳时的电动上样或线上浓缩堆积等。
(7) 根据用法的类型分类
1) 双向电泳:使用不同电泳分离原理进行样本分类的一种电泳技术,常见凝胶双向电泳,其原理为第一向基于蛋白质的等电点不同用等电聚焦分离,第二向则按分子量的不同用SDS-PAGE分离,把复杂蛋白混合物中的蛋白质在二维平面上分开。
2) 交叉免疫电泳:交叉免疫电泳是一种有效的抗原蛋白定量技术,将区带电泳和火箭免疫电泳相结合,可一次同时对多种抗原定量。 分辨率较高,有利于各种蛋白组分的比较,对于蛋白质遗传多态性、微小异质性、蛋白质裂解产物和不正常片段等进行定性分析。
3) 连续纸电泳:根据电泳过程中缓冲液pH 是否保持不变将电泳分为连续和不连续电泳两种。连续纸电泳是以纸为支持物的pH 保持不变的一种电泳方法。
4) 层析-电泳技术:将色谱层析技术和电泳技术相结合的一种新型分离技术。 常见的电泳亲和层析技术属于此类,它将二者结合形成一种新型制备规模的生物分离技术。 其基本原理是利用电场强化扩散过程以加速分离过程的进行,从而避免了亲和层析在分离过程中,由于液相主体中的溶质分子必须经过一系列扩散过程才能进入到固定相颗粒孔内完成吸附或解吸等质量置换反应,且被置换出的物质再由颗粒内扩散出固定相颗粒进入流动相而引起的分离速度缓慢的缺点。
(8) 根据不同的使用目的分类
1) 核酸电泳:用于核酸片段分离的一种电泳技术,常见的凝胶电泳属于此类。
2) 血清蛋白电泳:即用电泳方法测定血清中各类蛋白占总蛋白的百分比。 对于肝、肾疾病和多发性骨髓瘤的诊断有意义。
3) 制备电泳:一种样本组分分离并收集的分离技术。
4) DNA 测序电泳:用于DNA 一级序列分析的电泳技术,现代测序多用毛细管电泳技术进行DNA测序。
(9) 常用的电泳技术:在日常实验中,根据实验者的习惯,又将各类电泳技术分为:
1) 醋纤膜电泳。
2) 凝胶电泳。
3) 等电聚焦电泳。
4) 等速电泳。
5) 免疫电泳。
6) 毛细管电泳。
7) DNA序技术。
8) 单细胞凝胶电泳。
(1)《测量、控制和实验室用电器设备的安全要求 第1部分 通用要求 》(GB4793.1-2007)。 本部分等同采用《 测量、控制和实验室用电气设备的安全要求 第1部分:通用要求 》(英文版IEC61010-1:2001),其技术内容和结构与 IEC61010 完全等同,并纳入了其技术勘误1和2的内容( 右侧用双竖线表示)。 本部分是对《 测量、控制和实验室用电气设备的安全要求 第1部分:通用要求 》( GB4793.1 - 1995 )( idtIEC61010 - 1:1990 )的修订。
(2)目前国内外均未检索到电泳仪的相关标准,暂时使用企业标准。
1.血清蛋白电泳 血清蛋白电泳是临床检验常规检验项目之一。新鲜血清经电泳后可分成白蛋白,α1、α2、β及γ球蛋白。 血清蛋白电泳图谱可初步了解患者血清蛋白全貌,通常用作初筛试验。
急性炎症或急性时相反应时常以α1和α2区带加深为特征;肾病综合征、慢性肾小球肾炎时呈现白蛋白下降,α2和β球蛋白升高;而慢性肝病或肝硬化呈现白蛋白显著降低,γ球蛋白升高2~3倍,提示免疫球蛋白(Ig)多克隆增高,甚至可见β~γ桥连。 更重要的是,单克隆免疫球蛋白(M蛋白)在电泳区带α~γ区呈现致密而浓集的单克隆蛋白增生区带(M蛋白区带)。 由M蛋白所导致的一组疾病,如多发性骨髓瘤、巨球蛋白血症、重链病、游离轻链病、半分子病、良性单株丙球血症和双M蛋白血症等,目前这类疾病已不罕见。血清蛋白电泳对这类疾病的早期诊断、疗效观察和预后判断均有十分重要的意义。
血清蛋白电泳既可使用琼脂糖凝胶电泳,也可使用毛细管电泳,后者自动化程度更高,分离效果更好,受到越来越多的临床实验室青睐。
2.免疫固定和免疫分型电泳 免疫固定电泳和免疫分型电泳都是用于检测M 蛋白。免疫固定电泳使用琼脂糖凝胶电泳,免疫分型电泳使用毛细管电泳。
无论免疫固定或免疫分型电泳,对于单克隆Ig增殖症、本周蛋白和游离轻链病、多组分单克隆Ig血症、重链病、多克隆Ig血症的诊断和鉴别诊断具有十分重要的临床意义,是一种既灵敏又特异的检测手段。
3. 尿蛋白电泳 临床进行尿蛋白电泳的主要目的是确定尿蛋白类型,查明肾脏损伤部位(肾小球、肾小管)。尤其是不能进行肾活检时,尿蛋白电泳结果能很好地协助临床医生判断肾脏的主要损害,帮助临床医生选择适当的治疗方案。常用的临床尿蛋白电泳是本周蛋白电泳、琼脂糖凝胶电泳、SDS-琼脂糖凝胶电泳(SDS-AGE)。
(1)本周蛋白电泳:是鉴定本周蛋白最有效的方法。
(2)尿蛋白琼脂糖凝胶电泳:虽然如同血清蛋白电泳一样,将尿蛋白分成白蛋白,α1、α2、β 及γ球蛋白,但实际开展的临床实验室不多。
(3)尿蛋白SDS-琼脂糖凝胶电泳(SDS-AGE):不需预浓缩,电泳图谱中蛋白按照分子量大小排列,非常直观。 中、高分子量蛋白区带主要反映肾小球病变;低分子量蛋白区带反映肾小管病变及溢出性蛋白尿;混合性蛋白尿则可见到大、中、小各种分子量区带,提示肾小球及肾小管均受累。 该技术的最大优点在于尿液不需预浓缩、操作简便、结果清晰,仅需3h即可完成试验,易于量化,便于分析,对肾脏疾病的诊断、鉴别诊断、指导治疗和判断预后很有价值。
4.血红蛋白电泳 血红蛋白病(地中海贫血、镰状细胞贫血、异常血红蛋白病等)是世界上发病率最高、危害最大的单基因遗传病。被WHO列为严重危害人类健康的六大疾病之一。 中国人群中异常Hb、β 地中海贫血基因和α 地中海贫血基因突变分别占70多种、34种和11 种,对该病以预防为主。血红蛋白电泳是筛查地贫的简便、准确方法,在临床上尤其在我国南方各省广为开展,如婚检、产检、新生儿疾病筛查。早期的血红蛋白电泳都是使用琼脂糖电泳技术,现在逐渐被毛细管电泳技术所替代。因为毛细管电泳在高压电场内利用电渗流作用,在碱性pH缓冲液中直接将血红蛋白组分分开。该方法无需进行洗涤红细胞的前处理,自动化操作十分便捷,大大提高了血红蛋白电泳的分离效率。
5.糖化血红蛋白电泳 糖化血红蛋白电泳通常指的是HbA1C电泳。在美国和欧洲HbA1C已经被公认为糖尿病诊断和长期监控的金标准。HbA1C最初是用电泳技术发现的,后被生化和HPLC方法所替代。随着毛细管电泳技术的发展,从2011年开始,市场上出现了毛细管电泳检测HbA1C技术,它比目前所用的HbA1C检测方法具有更好的分离效果,尤其是能够分离各种血红蛋白变异体,从而排除血红蛋白变异体对HbA1C 检测结果的影响。因此,毛细管电泳开创了HbA1C新一代检测技术。
6.其他临床电泳
(1)脑脊液电泳:脑脊液电泳又称脑脊液酶免疫标记电泳,用于检测脑脊液中的寡克隆蛋白,如多发性硬化症、痴呆、脊髓炎、神经性梅毒等中枢神经系统疾患。脑脊液电泳非常直观,且灵敏度高,是非常实用的检测方法。目前临床上开展脑脊液电泳都是在琼脂糖凝胶电泳上进行的,有常规脑脊液电泳和等电聚焦脑脊液电泳,后者分离效果更好,更易于解读。
(2)糖缺失性转铁蛋白电泳:糖缺失性转铁蛋白(CDT)电泳只能在毛细管电泳系统上进行。CDT是低唾液酸残基亚型的总称,在持续饮酒的患者中含量增高,已被公认为慢性酒精滥用的最可靠标记物。目前,酒精滥用已成为一个普遍存在的社会问题。酒精对饮用者可造成身体上多脏器的伤害,引起酒精性肝病(ALD)、酒精性糖尿病、酒精性精神障碍等多种疾病,其中以ALD最为多见。CDT检测可用于监测疑似慢性酒精滥用者;鉴别诊断酒精诱导性的以及非酒精诱导性的疾病,例如脂肪肝、肝硬化、胰腺炎、食管炎、胃炎;监控戒酒治疗;对GGT升高者进行鉴别诊断等。
(3)同工酶电泳:常用的临床同工酶电泳是琼脂糖凝胶电泳。同工酶电泳包括血清乳酸脱氢酶(LDH)同工酶电泳、碱性磷酸酶(ALP) 同工酶电泳、肌酸激酶(CK)同工酶电泳等。同工酶电泳的结果具有非常丰富的临床意义,仅以血清乳酸脱氢酶(LDH)同工酶为例,LDH同工酶经电泳后可分离出五种同工酶区带,LDH1/LDH2 异常对于心肌损伤、急性心肌梗死、心肌病等有临床意义,肝病患者LDH同工酶变化有其典型图形,如肝硬化时LDH2下降和LDH5升高,肝癌时LDH5明显升高。LDH同工酶都升高但相对值不变,对血小板增多病、结核、原发性肿瘤等有临床意义。
(4)脂蛋白电泳:脂蛋白电泳检测各种脂蛋白,包括胆固醇、三酰甘油和LP(a),主要用于高脂血症的分型、冠心病危险性评估,以及动脉粥样硬化性疾病及相关疾病的发生、发展、诊断和治疗(包括治疗性生活方式改变、饮食及调脂药物治疗)效果观察的研究等。脂蛋白电泳主要在琼脂糖凝胶电泳系统中进行,尚未见毛细管电泳用于临床脂蛋白电泳。
临床检验是疾病诊断和治疗的重要参考依据,随着现代医学飞速发展,临床医师对检验结果提出了更高要求,这就需要严把检验质量关,应将质量控制贯穿于分析前、分析中和分析后的整个检测过程。 临床电泳检验应注意和考虑以下几方面:
1. 对样本的要求 应该建立和严格遵守电泳检测各项目对于标本采集事项中的质量要求,如样本采集和处理、储存条件和运输,以及及时或短时检测等方面,若将不合格的样本进行电泳会直接影响检测结果和判读的复杂化。 例如,对于血清蛋白电泳分析,应采用分离获得的血清标本在低温下保存和运输。 不宜使用静脉全血,因为运输过程中的振荡,会使血液标本产生溶血,同时血细胞中的蛋白成分会溢出细胞,使血清中蛋白质的组成成分发生变化。 血清样本若长时间置于室温条件下,由于血清中含有多种蛋白酶,会降解蛋白质。 因此,临床电泳检测各项目对于样本的质量要求应予以保证和重视。 此外还应注意标本不可被交叉污染,若需要手工添加样本至点样处,尽量使用科学合理的样本区分和加样方式,以及不要将标本检测顺序及编号搞混乱。
2.对仪器安装使用条件的要求 目前各种原理和型号的商业化临床电泳仪,均是半定量或定性的筛查性检验分析系统,其实验室安装和使用条件各厂家都有各自的要求。 符合要求的实验室条件是分析仪器正常运作和检测准确的前提条件。 一般主要包括实验室的电源要求、工作环境的温度和湿度要求、设备用水要求以及实验工作台的要求等。 一些具有高度自动化和高分析性能的临床电泳设备,其实验工作环境应避免高频干扰和阳光直射。 良好的实验环境质量管理有利于电泳分析仪实现良好的、稳定的分析性能。
3.对仪器用于临床检验前的要求 仪器用于临床检验使用前,必须建立标准操作规程(standardoperation procedure,SOP)及相关的验证。
(1) 安装验证:主要内容是进行各种检查,以确认设备的安装符合厂商标准,尤其是安装条件和安装后的状态是否达到厂商的安装标准。
(2) 运行验证:根据标准操作规程的草案对电泳的检测项目进行验证,确认所检测的项目的结果符合规定的技术指标、确认仪器运行的稳定性和连续性符合临床检测的要求。
(3) 性能验证:验证电泳仪或相关检测项目的基本性能参数, 例如线性、准确性、精密度( 如CV% ),抗干扰能力等(具体参见各厂家相关产品说明书性能参数)。对于某些特殊检测项目的验证,除了使用普通质控品之外,还应使用异常质控品。SOP文件除了规范分析操作,还应规范电泳仪的保养和维护。
4. 检测者的要求 临床电泳检验工作者应具有良好的临床电泳检验的基本理论基础,经过相关专业培训,理解电泳图谱的多样性、特殊性和复杂性,而非仅仅基于数值结果的判读。 在操作此类仪器时,应该了解仪器原理、操作流程、仪器检测程序和仪器的保养方法。 目前,电泳检验范围广,包括血、尿和脑脊液多种样本,检测项目多,为此对电泳检测结果的判读,应不断学习和提高正确解读电泳图谱的能力,并必须密切结合临床,对不易进行判断的实验结果,特别是涉及疾病的辅助诊断的项目,应结合其他项目进一步验证。 应遵守本科室电泳的筛检规则,严格按照筛检规则处理程序对样本进行有序分析。
5.室内质量控制
(1)选择有效可靠的质控物:用于自动化电泳分析的质控品已商业化,这有利于用户的实际应用。目前较成熟的商业质控物主要用于血清蛋白电泳分析,应注意的是商业质控物因为久放等原因,必须经过各种处理,如冷冻干燥、化学试剂处理等,从而减少电泳之分离效果可能会存在各部分蛋白间区别不明显的现象。
可以考虑用正常人血清制备质控物。先收集正常人新鲜血清,估计够一年之用。将其用小试管分装成各小部分,封口冷冻保存,每天取一小管当做正常标本尽心电泳分析。
(2)实验室赢根据自己的实际情况建立质控品均值和标准差:在试剂、仪器操作等条件必须保证正常状况下,连续20天检测,可得到一组数据,计算均值和标准差,作为暂定均值和标准差。之后累计3-5个月的数据作为常规均值和标准差。在更换质控品新批号时u,赢重复以上步骤。
(3)实验室赢确定质控方法、频次和质控规则:检查随机误差和系统误差。每天工作时,把质控品插入患者标本中进行电泳分析,每个电泳批次至少做一次质控。根据定性和定量方法不同,选择合适的质控规则,并做好记录,绘制质控图。
6.不同检测系统的比对和不同实验室间的比对
对于同一实验室存在不同的电泳检测系统,且同事在临床开展检测时,为保证检验结果一致性,同事为减少对临床医生造成困扰,实验室应对不同的检测系统的电泳结果进行比对。
实验室应建立参与外部质量评价(EQA)计划组织的实验室间比对活动程序,以判断该检验程序的可接受性。如不能参加EQA或EQA尚未开展的项目,实验室应定期(每6个月至少1次)与权威实验室或较高资质实验室进行比对。
1.人员的要求 电泳仪器自动化水平逐渐提高,一般常规检测操作对人员要求不高,在上岗前进行必要的培训和通过考核即可。但检测结果的分析、修改和报告的审核需要检验人员具有医学检验工作背景和在电泳项目上具有丰富的经验。
2.合适的环境 足够和适宜的空间,按仪器厂家要求提供合适的温度、湿度环境。
3.仪器的校验 按医学实验室认可要求,实验室仪器需定期进行校验,以保证实验结果的准确。电泳仪也不例外,一般每年校验一次或按仪器厂家规定周期进行。该工作一般由厂商或代理商公司的工程师完成,并提供书面校验报告。
4.试剂的质量保证
(1)商品化电泳试剂的保存:目前,自动化电泳技术的临床应用已日趋成熟,每个厂家的配套试剂均有明确的使用说明,一般遵照试剂的保存条件及要求去操作,所造成的误差是可以避免的。具有生物活性的试剂(如抗体、酶等)保存要求,实验室应严格遵循。
(2)凝胶片保存:一般储藏于室温(15-30℃)。储藏温度应避免过大变化,不能冷冻。但有时实验室人员不注意保存要求,将其保存在2-8℃甚至是冷冻条件下(0℃以下),往往导致胶片中水分蒸发或发生“破裂”现象,因此在电泳时,区带结果会发生改变甚至不出现区带结果,或者整个胶片根本不能使用。凝胶板在原包装袋内应平放,应避免放置在近窗户处或近热源处。遇下列情况应停止使用:①凝胶表面有结晶、沉淀或凝胶变软(均因凝胶受冻所致);②有细菌或真菌生长的迹象;③凝胶包装袋内有异常液体(因储藏不当,凝胶内缓冲液渗出)。
(3)对于不同批次的试剂,不要混合使用,避免造成结果的偏差。
5.电泳操作过程中的注意事项 不同的检测目的、不同的标本类型和不同的检测技术等原因,导致临床使用的电泳检测方法分很多种,如:血清蛋白电泳(按电泳介质又分醋酸纤维薄膜电泳和琼脂糖电泳等)、同工酶电泳、糖化血红蛋白电泳、尿蛋白电泳、脑脊液电泳、免疫固定电泳等,不同方法在操作过程中有相同的问题也有个性的问题。
(1)血清蛋白电泳操作注意事项和常见问题有:
1)电泳槽缓冲液的液面要保持一定高度,过低可能会增加y球蛋白的电渗现象(向阴极移动)。同时电泳槽两侧的液面应保持同一水平面,否则,通过薄膜时有虹吸现象,将会影响蛋白分子的泳动速度。缓冲液一般可反复使用,但不宜超过10次。
2)电泳图谱不整齐,原因有:点样不均匀;薄膜未完全浸透或温度过高致使膜面局部干燥或水分蒸发、缓冲液变质;电泳时薄膜放置不正确,薄膜与滤纸桥的接触不良,使电流方向不平行。
3)蛋白各组分分离不佳,原因有:点样过多;电流过低;薄膜结构过分细密,透水性差、导电差等。
4)染色后白蛋白中间着色浅,原因有:染色时间不足或染色液陈旧;蛋白含量过高。后者可减少血清用量或延长染色时间,一般以延长2分钟为宜。若时间过长,球蛋白百分比上升,A/G比值会下降。
5)薄膜透明不完全,原因有:温度未达到90℃以上将标本(醋纤膜条)放入烘箱;透明液陈旧和浸泡时间不足等。
(2)血红蛋白电泳常见问题有:
1)某些纯合子“S"在使用“ Hydrea®”(羟基脲)治疗后,会导致出现类似胎儿血红蛋白的合成。这种诱导产生的血红蛋白F在使用 CAPILLARYS HEMOGLOBIN(E)试剂电泳时迁移率与生理性的血红蛋白F没有什么不同。
2)不要使用未经沉淀过的血标本。不要使用已经发生溶血的血标本。不要使用过期或保存不当的血标本,在过了7天的保存期后,会产生有降解产物(或人为污染物),这将会影响到电泳图谱。在过了10天保存期后,红细胞上将有黏性聚合物沉着,在进行分析之前必须将其弃去。
3)当检测到与主要的血红蛋白变异S、C、E、O-Arab和D不同的异常血红蛋白时,可用其他的鉴别方法(如球蛋白链电泳等),或会诊或将标本送至专科实验室进行于检测。
(3)免疫固定电泳常见问题有:
1)当血清电泳参考泳道呈现单克隆类型条带,而免疫固定电泳并未呈现,则首先应考虑纤维蛋白原(血浆样品)的可能。
2)若在所有免疫固定泳道均呈现单克隆条带,则考虑冷球蛋白或多聚lgM可能,用还原剂解聚后再进行检测。
3)冷冻复融的样本在点样处可能产生蛋白变性的痕迹。
(4)脑脊液电泳操作注意事项和常见问题有:
1)脑脊液和血清需同时向同一患者采集,任何治疗将会改变患者样品中免疫球蛋白的浓度,应予避免。
2)脑脊液和血清中的lgG浓度需准确测得,以保证两者能调节至相同的浓度进行点样。
3)如果未知lgG浓度,则血清应该稀释300-400倍而采用纯脑脊液。那么在进行结果解释的时候应该考虑到不同的lgG浓度可能造成的不利后果。
4)试剂与抗血清须配套使用,否则会影响结果,可影响到电泳的分辨率和灵敏性,并观测不到某些单克隆条带。
6.参考区间的建立或验证 由于电泳方法学、生产厂家、试剂、仪器等多因素的影响导致各实验室间结果相差相对较大,建议实验室建立自己的参考区间。建立参考区间时,为减少出现偏差,正常人群的选择一般要在120例以上。如果建立参考区间难度太大,也可选择厂家说明书推荐的或权威文献报道的使用相同方法、相同仪器、相同人群的参考区间进行验证,合格后采用。验证例数一般不少于20例。
以醋酸纤维素膜血清蛋白电泳的参考区间为例,可以用各组分蛋白的百分率或实际浓度(绝对值)两种方式报告,若有可能最好同时报告两种结果,如表12-1。
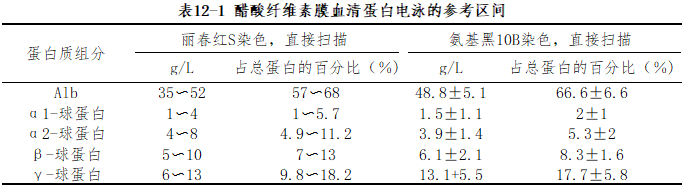
7.性能验证 实验室应有相应程序定期评估或验证所使用的方法和程序,并记录归档。验证内容应包括但不限于以下内容:精密度、干扰实验、准确度、生物参考区间等。
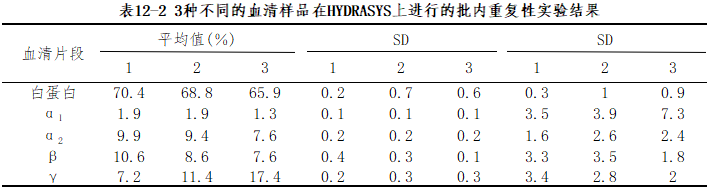
(1)精密度:分析方法对同一样本产生重复测量相同值的能力。包括批内、批间、日间精密度和总精密度。为减少对结果的影响因素,全部实验过程中应使用单一批号的试剂和校准物。选择标本时应考虑医学决定水平,推荐使用2个或以上浓度的样本。同时还需注意:校准物、试剂的正确保存、使用,仪器的正常维护,样本的稳定性。
例如,在HYDRASYS上进行的批内重复性实验:取3种不同的血清样品,分别使用3种不同批号的试剂,且每个样本均在HYDRAGLPROTEIN(E)15/30凝胶上同时跑15个泳道。这样,每个样品各区带的平均值SD和CV(n=15)值通过计算获得。表12-2显示3种血清样本的结果。
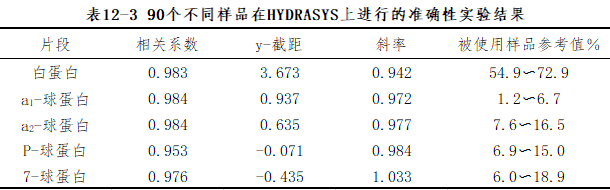
(2)准确度:是指测定值与“真值”之间的一致性。一般可通过与室间质评中同组均值比较获得,或与已知准确性良好的系统进行比较获得。例如在HYDRASYS上进行的准确性实验:取90个不同样品(病理性和正常血清)用HYDRAGELPROEIN(E)15/30和市场上另一个琼脂糖凝胶电泳试剂盒进行对照测试,结果见表12-3。
(3)干扰试验:是指除分析物外,其他成分对分析物测量的准确度的影响。蛋白电泳中常见干扰物质为药物、血脂和血红蛋白等。干扰试验中最好使用常规样本基质,如血清或血浆;如果加入的干扰物为液体,应尽可能减少其在样本中的体积比,可能时应控制在10%以内;为保证样本基质的一致性,原始样本中应加入不含干扰物的相同溶液,作为比对样本;对加入的物质能够实现准确定量,如称重、使用标准物质或标准液;应选择有临床意义的浓度加入基础样本,样本浓度选择3个浓度水平。一般加入的浓度接近患者样本中可能出现的最大浓度水平,所有样本应该进行双份测定。
 京公网安备11010102003307号
京公网安备11010102003307号

微信扫一扫
关注医隆网