本栏目由医隆网专家团队审核!
1934 年Andrew Moldaran首次报道了使悬浮的红细胞通过放置在显微镜载物台上的玻璃毛细管,并用光电记录装置自动计数细胞的方法,从此迈出了从显微镜观察静止细胞向流式细胞检测技术发展的第一步。1947 年Gucker 发明了检测气溶胶中微生物的装置。该装置使用鞘流将样本引导到流动室中央,同时还使用了高亮度光源及光电倍增管等器件。Gucker 的装置更接近现代意义上的流式细胞仪。同一时期, Wallace Coulter 和Joseph R.Coulter兄弟发明了库尔特原理,该发明开创了细胞计数的新纪元,并于1953 年获得美国专利。次年Coulter公司推出了第一台血细胞计数仪Coulter Counter A。 直至今日,仍有部分流式细胞仪采用库尔特原理计数。
1953 年Parker 和Horst设计了一种全血细胞分析方法,他们先将全血细胞染色,当细胞悬液通过检测细玻璃管时用一束光照射,不同细胞所发出的不同的光经过滤光片后分别由两个光电转换器转换为电信号,再由计数电路分别计数。从原理上讲,这种分析方法在处理方式上同今天的流式细胞仪已经有些相似了。
Mack Fulwyler被认为是当今流式细胞仪的先驱者,尤其对于细胞分选仪。1965年Fulwyler 率先在Science 上发表了第一篇关于细胞分选的文章,他也因此被认为是“液滴分选之父”。Fulwyler 的分选是Coulter原理与喷墨打印机技术的结合体,当细胞经过小孔完成计数后,液流被分割成一连串小液滴并被充电,当其流经高压偏转板时发生偏转落入收集容器中。同期,曾跟随著名的细胞学、遗传学家Caspersson学习显微分光光度计技术的Louis Ka-mentsky在IBM Watson Laboratory 创建了一台名为“Rapid Cell Spectrophotometer ”(RCS)的流式细胞仪样机,并于1967 年在Science上公布了他的研究成果,很多人也因此把他看做是创立流式细胞仪的第一人。
1969 年德国科学家Dittrich和Göhde 研制了世界上第一台商品化的荧光流式细胞仪“ Impulscy tophotometer”(ICP-11),并由Phywe AG 公司推向市场。Louis Kamentsky 离开IBM 后创建了BBio/Physics Systems公司,并于1970 年推出了流式细胞仪Cytograf和Cytofluorograf,该公司于1972年被Johnson & Johnson旗下的Ortho Diagnostics 公司收购。1972年Herzenberg 开发出FACS,之后又与美国的Becton-Dickinson(BD) 公司合作开发商用的FACS,并于1974 年推出了BD的第一款流式细胞仪FACS-1。 Fulwyler 也离开了他在LosAlamos工作的实验室,进入Coulter公司继续研究流式细胞仪,在他的带领下,Coulteer公司于1975年推出了自己的新产品TPS-1。早期的流式细胞仪如20世纪80年代推出的双色T淋巴细胞计数仪、1994 年推出的单激光三色流式细胞仪FACS-Calibur依然在使用。
商品化流式细胞仪最初上市的几年,流式细胞仪的主要应用还是细胞DNA 含量测定,对流式细胞仪的功能要求不高,通常仅配备一个散射光和一个荧光信号的仪器即可满足需求。而自1975 年Köhler和Milstrin发明的单克隆抗体制备技术和包括人淋巴细胞表面抗原在内的抗体试剂和新荧光染料的逐渐推出,使得多激光、多荧光流式细胞仪的需求日趋明显,同时流式细胞仪的应用领域也不断扩大,促使流式细胞仪不断更新升级,获得了长足发展。在细胞生物学研究中,很多科学家开始尝试使用流式细胞仪进行细胞功能检测,如细胞内酶活性、细胞内钙离子浓度、细胞膜电位检测等。临床上流式细胞仪也开始用于淋巴细胞亚群分析、AIDS检测、白血病免疫分型和微小残留病变检测、HLA-B27检测、PNH检测等,逐渐成为临床不可或缺的辅助检测手段。DNA含量分析也逐渐扩展至凋亡细胞分析、精子成熟度检测、肿瘤细胞倍体检测和侧群细胞分析。
1997年美国的Beckman公司并购了Coulter公司,并改名为Beckman Coulter 公司,同年推出第一台单激光四色流式细胞仪EPICS XL,于2000 年升级为数字化的EPICS XL-AD推出。2003 年Beckman Coulter 公司推出了带高通量自动进样器的单激光五色流式细胞仪 FC500 MCL/MPL和具有绝对计数功能的Quanta SC 。一年后BD公司推出了其二代具有双激光六色检测能力的流式细胞仪FACS Canto。 到2008 年Beckman Coulter 又进一步推出了第一台具有三激光十色检测能力的分析型流式细胞仪Gallios/Navios。几乎同时,BD公司也在不断对Canto 进行改进,在原有基础上将荧光检测能力拓展到三激光八色。而在流式分选仪发展过程中,20世纪90年代末Cytomation公司推出了MoFlo Legacy ,2002年Cytopeia 公司推出了Influx,两款仪器都属于高速流式细胞分选仪,样本流速可以达到100 000 个/ 秒,同时还可以配备多根激光器及十几个颜色的荧光通道。 随后Cytomation 公司被Dako 公司收购,推出新一代的MoFlo XDP和CyAn分析仪,2008年Beckman Coulter收购Dako 的流式细胞仪业务后又推出全面数字化高自动化的高速分选仪Moflo Astrios,成为高端流式市场的领导者。同期,BD公司收购了Cytopeia公司的Influx。
国产流式细胞仪最早研制于20 世纪80年代初,上海第二医科大学生物物理教研室和一些其他的科研院所均自行研制过流式细胞仪,但受到当时科技发展和国内生产力的限制,这些流式细胞仪均未能成为商业化的产品。而进入21世纪国内企业的科研实力获得飞速发展,至2010 年起开始了流式细胞仪的设计、研发和生产,迄今已推出了中国自主研发的具有绝对计数功能的从单激光至三激光甚至高达13 种荧光颜色的流式细胞仪BriCyte E6、NovoCyte 系列等,并已获得CFDA医疗器械注册证。国内的迈瑞公司和艾森公司成为流式细胞仪生产企业的后起之秀。
我国自主研发的流式细胞仪从性能上不仅能够和国外流式细胞仪比肩,也有着自身的特色和优势。例如,具有可插拔滤光片,支持通道配置更改及灵活升级,可选配备自动加样系统,可实现24管/40管及6/24/96×多孔板上样,能够满足临床样本检测和科研需求,无需绝对计数管或其他耗材即可实现体积法绝对计数。
如今流式细胞术已经日臻完善,随着光电技术、计算机技术进一步发展,流式细胞仪已开始向模块化、经济型发展,即它的光学系统、检测器单元和电子系统更加集成化,并可按照实验要求进行灵活的调整和更换。 此外,临床型的流式细胞仪还追求更加自动化的操作,包括自动化的样本处理及与LIS 的双向通讯等。 现在,流式细胞术已成为免疫学、细胞生物学和临床医学等领域中的重要工具。
流式细胞仪按功能结构分类可分为分析型流式细胞仪和分选型流式细胞仪。
(一) 分析型流式细胞仪
用于快速分析检测细胞组分及颗粒悬液,通过同时检测分析液流中细胞上的多种信号,对细胞加以细致的区分鉴别,临床检验主要使用此类流式细胞仪, 例如BriCyte E6、Calibur、Canto、FC500、Navios、NovoCyte 等系列,均已拿到CFDA注册证。 此外还有CyFlow、CytoFLEX、Gallios、Guava、LSR、MACSQuant 等各类配置的科研型流式细胞仪。
(二) 分选型流式细胞仪
用于快速分离获取目的细胞,在分析检测基础上,通过分选模块对细胞加以分离。 电荷式分选是目前主流的分选方式,具有分选效率、纯度高,不易污染等特点, 例如Aria、InFlux、MoFloAstrios EQ、MoFlo XDP、S3 等流式分选仪。
(三) 全自动式流式细胞仪
根据临床常规检验的需求,临床型流式细胞仪向着更自动化的操作流程和更好的生物安全性能发展。 为了进一步简化临床操作,全自动式流式细胞仪具有自动样本加样、溶血、检测,检测结果通过双向LIS自动上报等类似血细胞分析仪的全自动化功能,即人工放入血样管,无需下一步人工干预,仪器就能得到结果,大大提高了实验室的工作效率和管理效率,减少可能的人为误差, 如Aquios CL、AutoCyte等全自动流式细胞仪。
(四) 图像型流式细胞仪
将流式多色检测技术和荧光显微镜图像显示技术相结合的一种流式细胞仪,通过荧光信号的强度及荧光图像对细胞亚群进行定性和定量分析,如 ImageStream 系列成像流式细胞仪。
(1) 《临床实验室质量保证的要求》(WS/T250-2005)。 本标准规定了对临床实验室质量保证的要求。 适用于一切从事医疗活动的临床实验室。
(2) 《 临床实验室室间质量评价要求》(GB/T20470-2006)。 本标准规定了对临床实验室室间质量评价申请的标本检测,各专业和亚专业室间质量评价计划的一般要求;各专业和亚专业室间质量评价计划的具体要求。 适用于开展临床检验服务的医疗卫生机构的临床实验室。
(3) 《临床实验室定量测定室内质量控制指南》(GB/T 20468-2006)。 本标准适用于开展临床检验服务的医疗卫生机构的临床实验室的定量测定。
(4) 《医疗机构内定量检验结果的可比性验证指南》 ( WS/T 407-2012)。 本标准规定了对定量检验项目的多个检测系统实施结果可比性验证的要求,包括可比性验证方案的使用条件和适用情况、验证方法和程序、验证结果不符合要求的处理措施。 适用于同一医疗机构内的临床实验室。
(5) 《临床化学设备线性评价指南》 ( WS/T408-2012)。 本标准规定了临床实验室评价定量检测系统线性范围的方法、测定结果精密度的检查方法及离群值的剔除原则。 适用于临床实验室对新开发的测定方法的线性范围进行摸索及建立,也适用于临床实验室对现行测定方法的线性参数进行验证。
(6) 《流式细胞仪》( YY/T 0588-2005)。对单细胞或其他非生物颗粒膜表面及内部的生物化学与生物物理特性成分进行定量分析和分选的流式细胞仪的术语、定义、要求、试验方法、标志、标签、说明书、包装、运输和储存要求作了详细规定。
(7) 《流式细胞仪用单克隆抗体试剂》( YY/T 1184-2010)。 对使用流式细胞仪进行淋巴细胞表型分析、白血病/ 淋巴瘤分型或其他疾病的诊断和检测等所使用的免疫标记单克隆荧光抗体的术语、定义、分类、命名、要求、试验方法、标签、使用说明、包装、运输和储存要求作了详细规定。
(8) 《流式细胞术检测外周血淋巴细胞亚群指南》(WS/T 360-2011)。 对如何采用流式细胞术检测外周血中淋巴细胞亚群包括T细胞、B细胞、NK细胞、CD4-T 细胞、CD8+ T细胞作了详细规定,包括规定了标本如何采集、运输,如何使用流式细胞仪及应用免疫荧光染色技术检测和分析淋巴细胞亚群,结果如何报告和审核等。
(9) 沈立松、袁向亮、潘柏申等. 2013. 流式细胞术临床应用的建议. 中华检验医学杂志,36(12):1064~1073。 对流式细胞仪的校准与性能监测、FCM 临床应用的性能评估、临床FCM的质量控制、FCM 的工作人员职责和培训提出指导意见。
(10) Enumeration of Immunologically Defined Cell Populations by Flow Cytometry ( CLSIH42-A2-2007)。 该文档为使用流式细胞术进行淋巴细胞亚型和CD34+干细胞的免疫分型提供指导,样本和仪器的质量控制及从淋巴细胞和CD34+干细胞获得数据的注意事项,FDA已经评价并认可使用这个核准级的标准来满足管理的需要。
(11) Clinical Flow Cytometruc Analysis of Neo-plastic Hema to lymphoid Cells ( CLSIH43-A2-2007)。淋巴瘤细胞流式细胞术分析。
(12)Performance ofSingle CellImmune Response Assays (CLSII/LA26-A2-2013 )。 该文档包括细胞因子评价方法、主要组织相容性复合体定量、酶联免疫技术、羟基乙酸荧光素标记技术来评价细胞增殖。 提供样本采集、运送和制备的基本方法,结果解释、质量保证和确认方法。
(13) Red Blood Cell Diagnostic Testing Using Flow Cytometry(CLSI H52-A2-2014)。 这个文件介绍了应用基于荧光分析的流式细胞分析平台来完成红细胞的诊断分析,包括胎母输血综合征检测、
PNH筛查、膜缺陷性贫血检测遗传性球形红细胞增多症及有核红细胞计数的测试程序。 也讨论确认、质量控制和结果解释的注意事项。
( 14 ) Methods for Reticulocyte Counting(Automated Blood Cell Counters,Flow Cytometry,and Supravital Dyes)(ICSH H44-A2-2010)。 本文件为流式细胞术进行网织红细胞计数提供指导。 包括流式细胞仪网织红细胞检测方法的正确度和精密度,也是一个推荐的参考程序。
流式细胞仪的临床应用始于艾滋病的CD4+ T细胞计数检测,此后应用范围日益广泛,目前常见检测项目主要有以下几类:
(一) 表型分析及其应用
1.淋巴细胞表型检测 可检测淋巴细胞亚群(总T淋巴细胞CD3、T辅助/ 诱导细胞CD4 亚群、T杀伤/ 抑制细胞CD8亚群、B细胞CD19 和NK 细胞CD3- /CD56CD16)、淋巴细胞活化(HLA-DR、CD69、CD25、CD45RA、CD45RO 等)、Th1(CD4/ IFN-γ)Th2(CD4/ IL-4)、调节性T细胞( CD4+CD25bright /CD127dim)Th17(CD4/ IL-17A)等。 淋巴细胞是参与机体免疫应答的主要细胞,其测定值能够反映机体的免疫功能状况。 因此在肿瘤患者免疫能力评价、感染进展评价、免疫缺陷病、自身免疫性疾病及器官移植排斥反应程度评价等方面有重要参考价值。用于淋巴细胞亚群分析的方法主要有三种:荧光显微镜法、斑点酶免疫免疫法(ELISPOT)和流式细胞法。 流式细胞分析法以操作简便、速度快、样本用量少而信息量大、特异性高、稳定性和重复性好,特别是能同时检测两种以上的荧光,获取更多参数等优势,逐步取代前两种方法,成为科研和临床最常用的淋巴细胞表型分析手段。
2. HLA-B27检测 人类白细胞分化抗原复合物(human leukocyteantigen ,HLA)Ⅰ类位点B27 是迄今为止人类发现的与疾病关系最为确定的基因,HLA-B27与强直性脊柱炎(ankylosing sspondylitis,AS的相对危险度(relative risk ,RR)为101.5,即携带HLA-B27基因还与Reiter病、沙门菌感染后关节炎、耶尔森菌感染后关节炎及前葡萄膜炎相关,其RR分别为37.1、29.7、17.6 和14.6。脊柱关节病的诊断主要依赖于影像学证据,但发病初期患者很少表现出影像学改变,因此脊柱关节病早期诊断的敏感性一直很低。为此,2009 年国际脊柱关节炎评估工作组(ASAS)提出了新的中轴脊柱关节病诊断标准,其中把HLA-B27作为早期诊断的主要依据,使诊断的敏感性有了明显提升。HLA-B27的检测方法主要有微量淋巴细胞毒法(CDC 法)、PCR法和免疫荧光标记流式细胞分析法等。其中,CDC法操作复杂、特异性低,且易受操作者主观影响,临床上已很少使用。PCR法虽然特异性强、准确性高,但对技术条件要求高、操作烦琐, 且假阳性高。HLA-B27基因转录蛋白恒定表达于淋巴细胞,通过荧光标记抗HLA-B27抗体与淋巴细胞孵育,流式细胞仪分析,能够实现简便、快速、高特异性检测,目前已成为临床实验室检测HLA-B27的最常用方法。但是,在临床应用中切记,HLA-B27基因是人类白细胞分化抗原基因座位的位点,并非HLA-B27阳性均是强直性脊柱炎患者或潜在人群;有5% 左右的患者HLA-B27基因阴性,因此,并不能依据HLA-B27阴性排除该疾病。
3. 阵发性睡眠性血红蛋白尿CD55/CD59检测 阵发性睡眠性血红蛋白尿(paroxysmal nocturnalhemoglobinuria,PNH)是以补体介导的血管内溶血为特征的获得性造血干细胞克隆性疾病。 以糖基磷脂酰基醇(glycosyl-phosphatidyl ionositol,GPI) 合成缺陷,导致PNH 患者的血细胞膜缺乏GPI 连接
蛋白,采用荧光标记GPI 相关抗体,结合流式细胞术检测缺乏这些膜蛋白的异常细胞,并计算出异常细胞所占百分数,能够客观地判断异常细胞群和GPI 蛋白缺乏的种类与程度。 与传统的补体相关溶血实验相比,流式细胞术是PNH 诊断方法的革命性进步,成为PNH 诊断的直接依据。 检测目的细胞包括红细胞和中性粒细胞,也有单核细胞和淋巴细胞膜锚定蛋白的异常。 由于血红蛋白尿为早期诊断的唯一临床症状,长期以来PNH被认为是红细胞疾病,因此,红细胞也是流式细胞最早期检测PNH 的目标细胞,但是由于红细胞易受溶血和输血的影响,不能正确评价PNH 克隆含量,在流式细胞仪分析中,发现了锚蛋白在白细胞的表达异常,后来更关注中性粒细胞。 通过分析红细胞和中性粒细胞表面CD55 和CD59的表达,流式细胞仪可以将被分析细胞分为Ⅲ型细胞(正常表达CCD55 和CD59)、Ⅱ型细胞(部分表达CD55 和CD59,即CD55和CD59表达细胞的平均荧光强度降低1/2)和Ⅰ型细胞(细胞的CD55 和CD59 平均荧光强度更低1/2),还能够分别计算出红细胞和白细胞中这三群细胞的百分比。 由于CD59 和CD55 检测粒细胞的阴阳性区分度不是很好,而且不同样本间变异很大,最新的PNH诊断指南推荐使用FLAER。 嗜水气单胞菌属细菌产生的毒素aerolysin 可通过与GPI 蛋白连接在细胞膜上形成通道而导致正常细胞溶解,PNH 细胞由于缺乏GPI 蛋白使其具有抵抗毒素作用而最终保持细胞完好。 利用这一原理将aerolysin变异体(Flaer)标记荧光,联合CD59检测PNH 克隆。 这为检测白细胞PNH克隆提供了有效工具,结合其他GPI 蛋白,如CD14、CD157提高检测灵敏度。
4. 白血病、淋巴瘤免疫分型及微小残留病灶检测 白血病主要是造血干细胞/ 祖细胞因某些原因阻滞于某个阶段后出现克隆性异常增殖所导致的一组造血系统肿瘤。 不同类型的白血病,因其发病机制、病理学特点、临床病程不同,治疗方案及预后也不尽相同,所以对其类型进行鉴别是临床诊疗的关键依据。
MICM 是WHO 于2001 年提出的一种白血病分型方法,它综合运用形态学(mophology,M)、免疫学(immunology,I)、细胞遗传学(cytogenetics,C)和分子生物学(molecular biology,M)多方面证据对疾病进行分析,而流式细胞仪免疫分型是MICM 分型法中最重要的组成部分。 过去,常使用荧光显微镜分析细胞的类型、数量和分化程度。 由于操作复杂、分析速度慢及使用抗体数量有限等原因,该方法已逐渐被流式细胞法所取代,而流式细胞仪可以短时间内完成几万甚至几十万个细胞的检测。 此外,由于使用的荧光素抗体数量多,获取的信息量大,因此对细胞的鉴别能力也更精细、准确。 目前,流式细胞仪已成为白血病免疫分型的最重要工具。
5.CD34+干细胞计数 外周血CD34+ 干细胞被广泛用于骨髓移植及大剂量放/ 化疗癌症患者的骨髓重建。 临床上通常要求移植的造血干细胞数量要大于1.2×106 个/kg,因此确定合理的采集时间和采集次数以保证干细胞的质量就成为移植或重建的决定因素,此外,CD34+干细胞计数还用于脐血库干细胞存储等。
过去,常采用体外集落形成实验评估外周血干细胞数量,这种方法测试周期长,结果变异大,因此很难为医生提供有效的诊断依据。 相对于体外集落形成实验,流式细胞仪造血干细胞计数具有操作简单、速度快、精度高等特点,对于医生掌握最佳采集时间,准确判断采集的干/ 祖细胞数量具有非常重要的意义。 目前主要使用ISHAGE 方法对干细胞计数,通过干细胞CD34阳性、CD45 弱阳性以及前向散射光和侧向散射光分布的特点设门,同时加上7-AAD等细胞活性染料区分死、活细胞。
(二)DNA 含量分析及其应用
1.细胞循环周期分析 细胞的生命开始于产生它的母细胞的分裂,结束于它的子细胞的形成,或是细胞的自身死亡。 通常将子细胞形成作为一次细胞分裂结束的标志,细胞周期是指从一次细胞分裂形成子细胞开始到下一次细胞分裂形成子细胞为止所经历的过程。 在这一过程中,细胞的遗传物质复制并均等地分配给两个子细胞。 细胞周期分为间期和分裂期(M 期)两个阶段,间期细胞经历DNA 合成前期(G1 期)、DNA 合成期(S期)与DNA合成后期或有丝分裂前期(G2 期)。 处于细胞周期不同阶段的细胞DNA 含量不同,处于G0 和G1 期的细胞含有二倍体量的DNA,处于S期的细胞含有从二倍至四倍过渡的、不等的DNA 量,而处于G2 和M期的细胞含有四倍体的DNA量。 利用亲核酸的荧光染料,例如PI、DAPI、DRAQ7 等与细胞的DNA 碱基结合或插入DNA 碱基对中,结合或插入荧光染料的量与细胞内DNA的含量成正比,通过流式细胞仪检测荧光强度(荧光道数),经过软件拟合,就能推算出细胞内DNA 的含量,区分各细胞周期。 经过与正常二倍体细胞DNA 含量的换算即可计算出细胞内染色体的倍数。 流式细胞DNA 分析软件引入DNA 指数(DNA index,DI) 来表示细胞DNA 的倍体,DI 的计算公式:
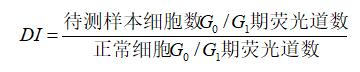
二倍体细胞DI=1,四倍体细胞DI=2,亚二倍体细胞DI=0.5,低倍体细胞DI<1,高倍体细胞DI>2,非整倍体细胞DI 非整数。
恶性肿瘤细胞的重要特征之一就是细胞无限制生长、细胞核增大、核内染色质增多,其实质就是细胞核内DNA不断异常复制。 非整倍体、高倍体或低倍体等异常倍体与细胞的恶性程度相关,但并非所有肿瘤细胞特别是恶性血液病细胞不一定都有倍体的异常。有异常DNA 含量的细胞其DNA 倍体异常与肿瘤的发生、发展密切相关,测定DNA 倍体对恶性肿瘤的程度判定、治疗方案选择及预后判断具有重要价值。
在流式细胞术应用之前,检测细胞周期主要通过图像法,在进行DNA 倍体分析的同时还能对细胞(核)形态进行观察,但是由于是手工操作,该法分析细胞数量有限,分析速度也较慢,并且极易受操作者的主观影响。 而流式细胞仪法检测的细胞数量多,分析速度快,不仅能做定量分析,还能对细胞周期时相做出判断。 由于两种方法在DNA 倍体分析上各有优势,因此临床常将两种方法结合起来,综合运用,以提高DNA倍体分析的准确性。
2. 流式细胞仪检测凋亡 细胞凋亡是指机体细胞在发育和生长过程或某些因素的作用下,通过细胞内基因及其产物的程序调控而发生的一种死亡方式。 它不仅在生物个体发育、正常细胞更新及维持组织正常结构和功能中至关重要,而且在心血管病变、神经性病变,以及肿瘤的发生、发展和转归中发挥着重要作用。 因此,细胞凋亡检测是基础研究和临床应用研究的重要内容。 检测细胞凋亡的方法很多,如电子显微镜或者光学显微镜下的形态观察、细胞DNA 提取物的DNA梯状带电泳实验等。而流式细胞术是非常重要的检测细胞凋亡的方法,具有简单、快速、可定量等特点,目前已成为科研领域研究细胞凋亡的最常用方法。 流式细胞术检测凋亡的方法也有很多。 常用的有:①染料摄取与排除能力检测。 坏死和凋亡晚期细胞丧失排除阳离子染料的能力,短时温育即被染色,而活细胞仅摄取少量染料。 台盼蓝( trypan blue )、乙啶(ethidium)、碘化丙啶(propidiumiodide,PI) 和7-AMD等均有上述特性。 二乙酰荧光素(fluoresceindiacetate,FDA),易被活细胞摄取,一旦进入细胞被其酯酶水解,产物发强荧光,与PI 共育,流式细胞仪可方便鉴定出死细胞(PI阳性)和活细胞(FDA阳性)。 凋亡阶段膜转运功能下降早于排除离子染料能力丧失,细胞对荧光染料摄取速度较对照增加,但又明显低于坏死细胞,染色介于正常细胞与坏死细胞之间。 Hoechst33342(HO 342 )或Hoechst 33258(HO 258)就是利用凋亡与正常细胞在染色浓度和时间上的差异而加以鉴别。 方法是用HO 342和PI同时标记细胞,分析时先在HO 342和PI 双参数图中分出坏死和活细胞,再将增益(gain)提高5倍,区分出活细胞中正常和凋亡细胞,继而设PI/HO 342比值与FSC双参数,明确区分正常和凋亡细胞。②光散射分析。 细胞凋亡的早期细胞皱缩、体积缩小、密度增加和光散射降低, FCM 中FSC 降低和SSC 增加。 适用于群集性好的细胞,若细胞异质或分为两群,则不宜用。 ③细胞DNA 含量分析。 凋亡细胞由于其断裂的小片段DNA 从细胞内泄漏,导致细胞内DNA含量减少,未经固定或破膜处理的细胞经PI 标记,流式细胞仪DNA 含量分析出现亚G1 期峰即A0 峰(apoptotic peak)。 细胞碎片、凋亡小体、增殖细胞破碎的单一染色体、染色质团块、线粒体、细菌污染等都含低量DNA,若用对数分析,会将其误认为凋亡细胞,因此,建议用线性取数④annexin V/PI双染色法,细胞凋亡时细胞膜磷脂外翻,如果将亲磷脂酰丝氨酸的annexin V标记绿色荧光染料,并与PI联合使用,可以检测凋亡早期(annexin V阳性)、凋亡晚期或者坏死细胞(PI 与annexin V双阳性)。 ⑤DNA 链断裂点标记。 常用末端核苷酸转移酶(TdT)脱氧三磷酸腺苷(dNTP)缺口末端标记(terminal deoxynucleo tidyl transferase UTP nick ens labeling ,TUNEL)法。 TdT 催化外源性dNTP结合到DNA缺口断端,荧光标记的dNTP与DNA 缺口成正比,同时用其他荧光染料结合表型或DNA 含量分析,能够确定凋亡的细胞类型或细胞周期时相。 只要有DNA 断裂,即可检出,甚至早于形态学改变,是目前凋亡检测中普遍适用的方法。⑥活化的Caspase-3检测和凋亡蛋白、凋亡信号通路检测。 结合以上方法和膜蛋白、胞质蛋白及核因子等凋亡相关成分标记荧光,即可检测,可用于凋亡信号、机制等的研究。
(三)其他标记和应用
感染指标如CD64+ 粒细胞百分比,以及血小板计数和活化,血小板遗传性疾病,网织血小板、网织红细胞检测,肿瘤侧群细胞检测和HLA 配型等。 利用荧光微球包被单克隆抗体检测(血液、体液和细胞培养上清中的)可溶性蛋白,以标本用量少(25~50μl)、高通量(理论上一次可以检测100种以上的标记分子)、速度快而成为新的可溶性蛋白检测技术。 该技术也可以检测PCR扩增产物等。
一、仪器选购的质量保证
(1) 至少选择3 家不同品牌仪器供应商,让供应商提供各自用户名单。
(2) 从用户名单中分别选取1~2 家实验室进行实地考察,听取用户意见,包括检测速度、样本类型、样本采集要求、样本用量、检测不精密度、灵敏度、正确度、干扰试验、仪器价格和售后服务等。
(3) 对于没有用户的新仪器,则可以通过咨询仪器评估单位的意见或通过询问厂商相关技术或销售人员,详细了解以上仪器相关性能信息,必要时可到厂家实地考察或在签署购买合同时增加仪器质量保证条款,以保证选购仪器的质量。
(4) 综合考虑医院患者人群特点、患者数量、仪器用户群信息、用户意见、检测系统的完整性(即有配套质控品、校准品和试剂)及与现有仪器的可比性,得出仪器选购意向。
(5) 仪器选购招标参数的设置,在自己关注的仪器性能特征前标注∗号,表示该性能特征必须满足要求,一般∗号标注的性能特征为意向选购仪器特有的性能特征,建议∗号标注的性能特征≤3个,
同时建议在参数设置时将仪器保修和售后服务内容也列入其中。
二、仪器使用前的安装调试与性能验证
1. 仪器验收 安装前要与设备管理部门一起对仪器进行开箱验收,包括仪器外观完整性和仪器配置清单与购买合同的一致性,按照配置清单逐一清点验收。
2. 仪器安装 选择避免阳光直射、干燥、避免热源、方便开展工作、平整的地面或桌面安装仪器。
3. 仪器调试 按仪器说明书连接所有试剂和通讯端口,接通电源,用鞘液连续测定几次使管路充满试剂,然后进行荧光灵敏度、荧光线性、前向角散射光检测灵敏度、仪器分辨率、前向角散射光和侧向角散射光分辨率、倍体分析线性、表面标志检测准确性、表面标志物检测重复性、携带污染率和仪器稳定性等方面的调试。 流式细胞仪的荧光灵敏度用可溶性荧光分子数(MESF)表示。 应满足要求:FITC 的荧光灵敏度≤100,对藻红蛋白(PE)的荧光灵敏度≤100;流式细胞仪荧光强度的线性相关系数(I)≥0.98;前向散射光检测灵敏度≤1μm;前向散射光和荧光信号的荧光通道全峰宽或半峰宽CV≤2% ;应能区分外周血中红细胞和血小板,能区分淋巴细胞、单核细胞和粒细胞。 当用于二倍体细胞周期分析时,G2 / M 与G0 / G2 的平均荧光强度比值应在1.95~2.05;检测质控血时,CD3、CD4 和CD8 阳性百分比结果应在给定范围内;重复检测样品CD3、CD4 和CD8 阳性百分比结果的变异系数≤10% ;携带污染率≤1% ;环境温度变化不超过设定温度的5% 时,8h 内检测FSC 及所有荧光通道(FL1、FL2、FL3 及FL4)峰值荧光道数的波动范围应不超过±10% 。
4. 仪器性能验证
(1) 仪器性能验证内容:至少包括精密度、灵敏度、准确度和生物参考区间。
(2) 精密度:分析方法对同一样本产生重复测量相同值的能力。流式细胞仪的精密度是通过对标准颗粒检测其散射光和荧光的分布范围来描述的,通常以变异系数(CV)来说明。CV值越小,表明测量误差越小,精密度越高。理想的情况下,如果一群含量完全相等的样本,用流式细胞仪来测量,CV=0,测量曲线如下图左,但在整个系统中,会带入很多误差,使实际测量曲线结果如下图右(图5-3)。当使用荧光微球或生物活性细胞评估仪器的精密度或进行质控时,样品能发出足够数量的光子,因此可不考虑光子的统计学变异对荧光变异的影响,一般的流式细胞仪在最佳状态时,都可以达到CV<2%,满足大多数实验项目的要求。

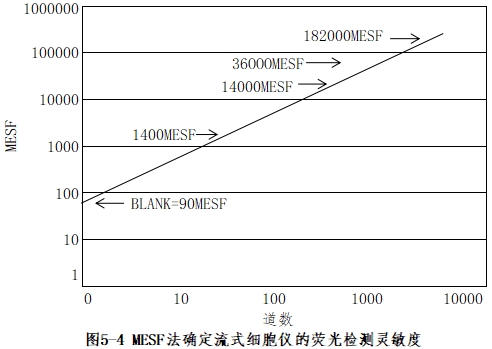
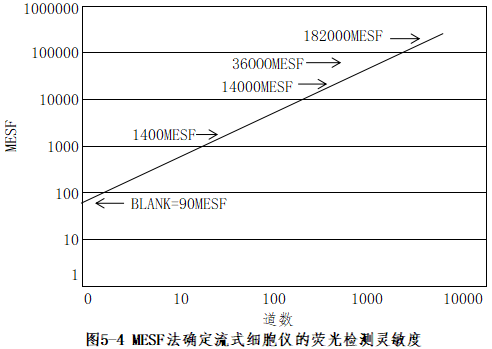
(3) 灵敏度:灵敏度的高低是衡量仪器检测微弱荧光信号的重要指标。一般以能检测到单个微球上最少标有FITC或PE荧光分子数目来表示。目前使用最为广泛的方式是流式细胞术标准化公司的MESF法。该方法所用试剂盒是由一系列标记有MESF值的微球组成(包括未标记荧光的空白微球),表明该微球所标记荧光物质的荧光强度等同于溶液中荧光染料的分子数。例如,标记有MESF值为1000的FITC微球,其荧光强度等同于1000个FITC分子。根据这一系列微球检测结果的平均荧光强度通道数进行线性回归,可得到流式细胞仪灵敏度的回归曲线,回归曲线与Y轴的交点即为该仪器的灵敏度,或称最低检测限(图5-4)。
(4) 准确度:是指测定值与“真值”之间的一致性。一般可通过与参考方法比较获得,或与室间质评中同组均值比较获得。流式细胞仪的准确度同精密度和灵敏度相比不重要,这主要是由于有太多的因素可影响其准确性,其中最为重要的就是非线性问题。一个典型的例子就是DNA定量,通常G2/S期的细胞,其DNA含量应为G0/G1期细胞的2倍;但实际检测时,如果仪器进行数据处理时采用的是脉冲高度值而不是脉冲面积积分,那么检测值会略高或者略低,其原因就在于脉冲高度值与真实值之间的非线性。随着定量流式细胞技术的发展和用户对荧光定量重视程度的增加,流式细胞仪准确度的评价和质控也开始受到重视,在样品中加入内标或某些生物活性细胞,如鸡或鱼的红细胞,可以对仪器准确度进行有效监测。
(5) 生物参考区间:由于不同仪器、试剂、实验室、地域和民族、年龄和性别等因素,淋巴细胞亚群的参考范围会有差别,建议每个实验室根据本地健康人群建立本实验室的参考范围,或是在国内同一地区多家实验室联合,建立统一的参考范围。 并定期验证和调整,每次验证不少于20份健康人标本。
5. 仪器性能验证的步骤
(1) 相关人员的培训:包括样本采集、仪器操作和处理、维护保养、统计分析和评价报告撰写人员。
( 2) 根据仪器使用说明书撰写仪器操作使用、维护保养SOP、仪器校准SOP、仪器检测项目SOP、样本采集手册、室内质量控制SOP、室间质评SOP。
(3) 按要求进行仪器性能验证试验。
(4) 根据性能验证试验结果书写性能验证报告,并交设备管理部门归档。
三、样本采集、运送与保存的质量管理
1. 样本类型 适用于多种临床标本,如外周血、骨髓穿刺液、骨髓活检物、淋巴样组织活检物、浆膜腔积液、脑脊液、皮肤、黏膜(内镜活检物)、细针穿刺物等。
2.抗凝剂的选择 外周血标本可采用EDTA、ACD或肝素(肝素锂最好)抗凝。 如果用同一份血标本做白细胞计数和流式分析,则应用EDTA 抗凝。骨髓穿刺可用肝素。 其他体液用EDTA、ACD 或肝素均可,但保存的样本活性可能会降低,EDTA 的优点是成熟髓系细胞贴壁造成的损失及血小板聚集较小,但细胞散射光特征丢失较肝素标本快;由于相对大量的ACD 会通过改变PH而影响骨髓细胞活性,通常不推荐用ACD做骨髓穿刺抗凝剂。
3. 样本的保存 样本的完整性和细胞活性与抗凝剂的选择、运输、保存和温度息息相关。理想状态下,样本应在采集后立刻处理和染色。 短期保存(1h 或更短)应在室温(18~22℃);长时间保存血或骨髓标本室温即可,有些样本可能4℃为佳。 标本保存的时间上限取决于标本类型及其保存条件。 肝素抗凝的血和骨髓通常可保存至48~72h。 EDTA 抗凝的血和骨髓可保存至12~24h。 ACD抗凝的血和骨髓可保存至72h。 对于只做胞内染色的样本,可固定细胞以长期保存。 但此“固定染色”的方法取决于要分析的抗原特性和染色方式。 采用之前一定要进行新鲜标本的对照和验证实验。
四、样本制备的质量管理
(一)单细胞悬液的制备
1. 血和骨髓 天然单细胞悬液。 当有血凝块时,应用50μm 尼龙网过滤,同时进行细胞计数和血涂片以判断靶细胞群体是否存在。
2. 组织块 包括机械分离和酶分离两种方法。 分离不仅是要获得最大产量的单细胞悬液,还要尽量保证细胞结构的完整性和抗原性。 大多数淋巴样组织可用轻柔的机械方法快速分离,并保持收获细胞的相对完整。 某些组织由于细胞间连接紧密,需在机械分离的基础上用蛋白水解酶如胰蛋白酶、胃蛋白酶处理。 骨髓标本亦可能因骨细胞成分污染而需要酶消化。 但使用酶法一定要确认酶的使用没有改变或减弱靶抗原的表达,未显著降低细胞活性。
(二)分离靶细胞群体
样本的任何处理方式都可能导致靶细胞群体的丢失。 所以应尽可能使用最接近原始标本状态的处理过程。 去除红细胞是外周血、骨髓等检体单个核细胞流式分析的必然步骤。
1.红细胞裂解 操作简单、快,并最可能保持原始标本的白细胞分布。 溶血剂的选择应基于其选择性去除成熟红细胞而最小程度地影响其他细胞的特点。 最好在染色后溶血。 若在染色前溶血,需确认:抗原性不被溶血过程改变; 溶血剂被彻底洗去,细胞和抗体结合的动力反应未受影响;所用溶血剂不含固定剂,否则会影响细胞活性及表面标记结果。
2.密度梯度离心 白血病细胞回收较好并可能得到富集,同时去除死细胞。但费时,白血病细胞的相对频率较难分析,某些重要细胞群体可能选择性丢失。 根据密度梯度原理,若白血病细胞没有与淋巴细胞相似的浮力密度即可能丢失。所以用此方法时应检查各层细胞特性以防止靶细胞丢失。
(三)评估细胞悬液
1. 样本外观 有严重溶血和血凝块的标本可能会有白细胞损坏及细胞亚群的丢失或改变,应弃用。
2. 细胞丢失和分布 确认细胞形态和原始标本相似。 密度梯度离心之后更应检查细胞分布。可做血涂片判断。
3. 细胞计数和浓度调整 厂家推荐的抗体浓度通常是假定靶细胞数量在正常范围内(500 000~1000 000/test Ab)。 白细胞数量上的显著变化会带来染色模式的改变。 而白血病标本常常有异常的白细胞数量,骨髓标本也可能被外周血稀释,这些标本的细胞数可能有极大的变异。 因此,会出现有些标本没有足够做流式分析的细胞数,有些则由于细胞量大,正常浓度下的抗体相对不足,不能饱和所有结合位点,导致结果失真。 所以染色前的细胞计数非常必要。 推荐方法:WBC<1000/ μl,用200μl全血并调整相应溶血剂用量;WBC1000~10 000 /μl,用100μl全血并用溶血剂标准量; WBC10 000~20 000/ μl,用50μl 全血并调整相应溶血剂用量;WBC>20 000/μl,用时稀释至范围内。 骨髓标本常常要在PBS1:10 稀释后计数。 应该指出,由于不同的标本中不同谱系的细胞比例不同,调整细胞总数不一定合适每一个谱系特异的抗体。 实验室若选择不同于厂家推荐的方法(如自己稀释抗体),抗体一定需要进行测试以得到抗体和细胞的最佳比率。
4.细胞活性 死细胞对许多抗体有非特异性染色,有些抗原同时存在于胞膜和胞质内,这就使样本的细胞活性检测变得重要,利用荧光染料碘化吡啶(PI)、7-氨基放线菌素D(7-AAD)或EMA(ethidium mono acide)进行死细胞染色,而活细胞拒染这些染料。 此方法的优点是细胞表面标志和活性分析可同时进行,通过设门即可得到活细胞的染色特性,尤其适用于高度坏死的样本。 样本染色后需固定,应在加固定剂之前洗去多余的7-AAD,以保证区分的是固定前细胞的活性状态。但随着时间延长,7-AAD会在固定的细胞群体重新分配,死、活细胞的区分变得困难。 对于染色后常规固定并在固定后12h以上分析的标本,最好用EMA。 EMA与死细胞DNA稳定地共价结合保证了长时间固定后仍能很好地区分固定前的死活状态。 二是手工检测,使用台盼蓝或其他细胞活性染料。
(四)细胞染色
1. 细胞膜表面染色 大多数可帮助白血病免疫分型的抗原在细胞膜上。 但由于许多抗原也同时存在于细胞内,所以在检测细胞表面抗原时应特别注意保持细胞膜的完整,以保证检测的特异性。例如免疫球蛋白重链在细胞内和表面的存在有不同的意义,检测表面标记必须是未固定的活细胞。
2. 细胞内染色 有些胞内特异性抗原的检测对白血病的免疫分型尤为重要, 如Tdt、MPO、cCD3、cCD22,以及胞质内Ig 的表达。 胞内染色的关键是使细胞膜通透,把抗体导入胞质而不影响细胞结构的完整性。 要保证固定和透膜的步骤不影响有关标记的抗原性以及和抗体的结合能力。
3. 胞膜和胞内的同时染色 通常,先胞膜染色、固定,膜通透后再胞内染色,最后是DNA 染色。固定剂和通透剂都可能对细胞和参数有不同的多重影响,应根据情况选择。 每一步染色对荧光素和抗体的选择都很重要。 例如,用于表面标记的荧光素应不被随后的固定和通透步骤所影响,而对于胞内染色,所用的荧光素应足够小以保证能穿透到胞膜内。
(五)抗体组合的确定
1.选择抗体组合的技术要求 基于血液肿瘤的复杂性,提供通用的抗体选择策略是不现实的。国际上迄今没有一致性的抗体组合。 没有一个神奇的既小又功能齐全的抗体组合可以解决所有的临床问题。 一个局限性的小组合也可能影响对样本的正确评估和分类。 确认细胞异常的能力与所用抗体的数量直接成正比。
2.选择抗体组合的基本原则 作为筛选时所选的抗体组合应足够宽,能够覆盖样本中的所有细胞亚群,包括正常和异常群体。 抗体的种类越多,能提供的信息越多,检测的特异性也越高。应该指出,由于肿瘤细胞常常缺少细胞的正常标记或表达异常,所以不同荧光标记的抗体一定程度上的重复选择有时是必要的。
抗体的选择应可以区分正常和异常细胞,正常细胞可作为实验的内对照,能够使异常细胞的表达比例更准确。 如现在用CD45抗体来区分正常和幼稚细胞,此方法在幼稚细胞含量少时更显优势。
荧光强度和表位密度应同时考虑。 对抗原表位表达少的蛋白标记应尽可能选择发射波较长的荧光染料。
必要时用细胞活性检测,排除死细胞较强的非特异性染色。 据国外统计,约70% 组织样本和48%血或骨髓标本因死亡细胞影响结果。
实验人员应了解所用抗体代表的细胞谱系,以及与特定荧光素结合后的染色模式。 相同CD 编号的不同抗体,由于抗体特定和识别的抗原表位不同而会有不同的结合模式和表达比例,这一点在检测中应当考虑到,并且需要熟练掌握常用抗体的这些特性。
3. 常用的抗体组合方案 临床上白血病免疫分型时,遇到多种抗体组合的问题,一般情况有两种方案,即大而全的抗体组合和分步标记。 前者能够一次性全面了解抗原表达,无需再次标记、检测,省时,但费用高。 后者先参考临床、血液分析和骨髓涂片细胞形态学等得出的初步诊断,选用有针对性的筛查试剂了解样本的一般情况,再根据所得信息选择特异性更高的二线抗体组合。 这种方法比较经济,但较耗时。 各实验室需根据临床和实验条件(如其他血液病诊断手段的开展情况)灵活选用。
五、分析中的质量保证
(一)样本获取
通常每个标本应获取(1~2)×104 个有核细胞的荧光和散射光信号,微小残余病变分析则需至少5×104个细胞。 取数的速度根据细胞的浓度设定,一般在150个细胞/ 秒左右。 不宜过慢,过慢影响检测进度,细胞数过少,则难以保证统计分析时足够的信息量和正确的统计结果。也不宜过快,过快如200 个细胞/ 秒以上,细胞流经聚焦点过快,难以保证单细胞通过和通过时充分的光信号获取。 应根据血液分析的白细胞数来选择样本的加样量和稀释与否。
在流式细胞仪FSC 和SSC 双参数点图上,恶性细胞的异质性常呈现大小和粒度范围更宽、不集中或多个小群的现象,获取细胞时设门和不设门的数据都要收集,以保留所有未知异常细胞群体,以免遗漏异常细胞,导致假阳性结果。 免疫荧光信号要求对数放大和至少256 道的分辨率。 无论选择对数或线性放大都要保证异常细胞都能被检测到。
(二)数据分析
只有通过多参数分析,才能最大程度地区分异质样本中的正常和异常细胞。 多参数分析意味着综合细胞的光散射和多色荧光特征。 至少要求4 个参数(2个光散射和2个荧光参数)。 采用的参数越多,分析步骤越复杂,对流式细胞仪的灵敏度要求越高。
1.分析技术 数据的分析方式随样本的特性、抗体组合及临床情况的不同而变化。 但总的原则是要用多参数的数据创造可以区分正常和异常细胞的图形,如FSC 比SSC、FL 比FL、Scatter 比FL等,散射光与荧光参数的综合分析常常能提供更有效的信息。
2.分析步骤
(1)首先分析所有细胞的抗原表达情况,鉴别出正常细胞和异常细胞群体,正常细胞的表现可以作为整个实验染色过程的内部参照,提供实验一致性的客观证据,异常细胞则通过进一步设门分析确定表型特点。
(2)设门:即选择特殊的细胞群体分析其各个参数的表现,是一个基本的分析技巧。 把分析局限在门内的细胞群体的前提是门内的细胞代表所有目的细胞,而且尽可能少其他细胞的污染。 一般来说,不同疾病的设门策略亦不同,常用的FSC 比SSC 的设门方式可能不总是适用于L&L 分析,如在急性白血病中,CD45和SSC 的双参数显示是鉴别幼稚细胞的一个简单而有效的方法;在B细胞淋巴瘤中用一个全B细胞的抗体设门来看κ 链和λ 链的情况;T细胞淋巴瘤时用一个全T细胞抗体设门使肿瘤细胞的分型更加明确。 另外,通过细胞特异的抗原表达确定其光散射区域的“backgate”的方法也很实用,如通过CD14 比CD45 的双参数分析区分多个区域的淋巴、单核和粒细胞群体。
(3) 分析异常细胞群体:确定异常细胞群体后要进一步分析其免疫分型。 分析抗原表达要注意:
1) 在L&L 中,定性的描述( 阳性或阴性) 通常要比阳性百分比的计算更有价值。 只有在设门内细胞全部是目的细胞而且荧光分布的形状可以非常清楚地区分阳性和阴性群的情况下,阳性百分比才有意义。 当然,在某些抗原异质表达的群体中,可进行定性或定量分析(X% 幼稚细胞CDX 阳性);百分比也可用于描述异常和正常细胞的比率。
2) 评估抗原表达强度是分析的重要组成部分。对于一个特异的抗体而言,荧光强度是抗原密度的反映,同时也与所用的荧光素和独特的荧光素抗体复合物有关。 确认异常群体有时是根据抗原表达谱系和时期的异常,但有时只能从抗原表达强度的异常来判断。 如用一些髓系抗原CD14、CD33、CDw65 的相对表达强度和散射光特征共同确认单核细胞系和粒细胞系的发展成熟过程。 荧光强度的评估在大多数情况是相对定量,但由于试剂和仪器的不同,仅仅基于荧光道数的简单标准可能不够准确,最好以其在相同条件下相对正常细胞的强度来表示。 如CD45,CD8 或CD38 等在不同细胞上的表达密度相差几个对数范围,CD22或CD4 等抗原在所谓阳性范围内在不同细胞类型上的区别则较小。
3)区分弱阳性和阴性群体。 在某些情况下对诊断有较大的价值,如B 细胞恶性肿瘤的CD5弱表达,但弱表达的判断却常常很难。 现行的标准如“20% 阳性”等都仍是人为的标准。 依照直方图上与对照组相比向右移动来判断阳性所需的最小位移也是人为的标准。 可用K-S 统计来比较直方图的区别,亦可选用强的荧光染料,或用过量小鼠Fc段抗体封闭,降低非特异染色,从而判断弱阳性染色的特异性。
(三)数据解释
虽然对流式免疫分型结果的解释最好与形态学结果结合,但流式细胞分析的作用则并非形态学结果的简单证实。 流式细胞分析可以帮助形态学确认某些诊断,也可以提出之前没有考虑的诊断,甚至在一些典型表现下可以与其他方法共同诊断,但应尽量解释任何流式细胞分析结果和其他方法结果上的不一致,流式细胞免疫分型应与临床资料、形态学、细胞遗传和分子生物学方法结合,尽可能为疾病诊断提供完整、准确的信息。
六、仪器管理
(一)设备管理部门
(1) 对仪器进行唯一性标识并根据仪器性能验收报告。 给予仪器状态标识,包括仪器名称、品牌、型号、生产厂家、购买日期、安装日期、校准日期、下次校准日期、校准者等信息。
(2) 根据仪器维修、校准响应时间,维修、校准后使用部门的反馈信息(返修率、校准内容和报告的完整性)等做好供应商评价工作,以供再次购买仪器时参考。
(二)仪器使用部门
仪器开始使用前:做好相关人员培训工作,包括样本采集、运送、处理、保存、单细胞悬液的制备、单克隆抗体的选择及与细胞结合的比例、细胞活性的检测、细胞表面染色、细胞内染色、胞膜和胞内染色,使相关人员了解和掌握每一环节中可能会影响检测结果的因素和技术,从而明确正确做法。
(三)仪器使用中的质量保证
1.检测人员 应根据SOP 做好仪器开、关机,日常维护保养和仪器状态监测工作,包括开展室内质控监测仪器的稳定性、参加室间质量评价监测仪器的正确性,以及进行仪器比对监测检测结果的可比性,并做好记录。
2.室内质量控制 推荐使用配套质控品和/或参加地区性质量控制计划使用统一的至少两个浓度水平的质控品(室内质控室间化),采用13s和22s 质控规则,也可根据仪器性能和临床质量要求制定自己实验室的质控规则。 每批最初5天,每天不同时段各测4次,共20个测试完成初始化,计算20个数据均值和标准差(s),均值作为质控的中心线。 每工作日至少在检测开始前先做一次室内质控,将质控数据及时输入质控软件,判断在控与否,在控后方可开始检测。如发现失控,应立即停止检测,分析查找失控原因,采取纠正措施进行纠正,对纠正后结果进行验证(证明原因分析正确、纠正措施得当、纠正结果有效)后方可继续检测,并对失控之前与前一次在控之间检测结果的有效性进行评估(样本有效期内的样本抽检、同一患者前后结果比较、患者结果与临床的符合性等),如果评估认为之前的结果无效,则应及时通知检测结果的应用者(医生和患者)停止使用此结果。 为了避免上述这种情况发生,建议在每工作日结束检测工作后加做一次室内质控,如在控则当天数据全部有效,如失控则可及时分析原因进行抽检或复测。
3. 室间质量评价 推荐参加获准认可的能力验证提供者的PT 计划,也可参加各省市临床检验中心组织PT计划或生产厂家的室间比对系统(实时在线比对系统)。 如果所有室间质评计划均没有覆盖到所开展的检测项目,应设法采用替代程序,如与同级或上级医疗机构实验室进行比对或实验室内部不同检验人员对同一样本检测结果的比对等,应对室间质评不符合项目进行原因分析,寻找可能改进的机会。 目前国内卫计委临床检验中心和上海市临床检验中心均开展有流式细胞术室间质评计划。
4. 仪器间比对 未参加室间质评计划的仪器、同一实验室有两台以上的仪器均做仪器间比对,至少每半年进行一次。 两仪器比对时应使用配套检测试剂、质控品和校准品,进行规范化操作。 正常开展室内质量控制仪器状态稳定,参加室间质量评价结果优良的仪器作为参比仪器,至少应用5份以上具有代表性的临床样本,用标准方法制备标本,与参比仪器比对,偏移应在预先设定的可接受范围内。
5. 仪器发生故障时的处理 仪器故障影响需要维修时,做好仪器故障和停用标识,以免误用。并向设备管理部门提出仪器维修申请,并联系厂家工程师维修,一般故障维修结束后工程师填写维修报告,由使用部门签字确认,保存维修记录。 如果故障比较严重,需要更换零部件,则需有设备管理部门到场确认更换零部件事宜,如果更换的零部件属关键部件,有可能会影响检测结果,维修结束必须进行仪器校准和校准验证,填写仪器维修报告和校准报告,由设备管理部门和使用部门共同签字确认,保存维修和校准记录,并由设备管理部门对仪器状态重新标识。
(四)仪器使用后的质量保证
(1) 结果审核:具有报告审核资质的检验人员要结合仪器散射光和荧光信号的光电倍增管电压、增益、颜色补偿等参数的设定情况、同型对照情况、设门情况、样本情况、临床患者信息综合考虑报告审核。
(2) 做好仪器的期间核查工作,以检查仪器两次校准期间是否存在偏移。
(3)根据仪器使用情况及法规和标准等要求制订仪器校准计划,校准计划至少应包括校准内容至少应包括加样系统、检测系统和温控系统,用于校准的物质名称、有效期,校准者的资质、校准周期等。 制订好的校准计划应交设备管理部门组织实施。
(4)校准的确认:审核人根据校准计划对校准后的仪器和校准报告进行核查并签字确认,校准报告需附有校准时检测结果的原始数据。 流式细胞仪的校准包括流路和光路的稳定性、多色标记荧光颜色补偿、光电倍增管转换的线性和稳定性。 主要是利用标准微球监测,聚苯乙烯可以被做成各种大小的微球,也可被荧光标记或拥有定量免疫球蛋白的结合位点。 这样制成的具有固定荧光强度、大小和光散射性的聚苯乙烯微球,已成为流式质控中常用的校准品。
1.人员的要求 检测人员需具有医学检验工作背景,需要取得流式细胞仪培训考核合格记录、仪器使用的授权许可证书、从事流式细胞仪临床检验的岗位授权许可证书等。
2.合适的环境 需要有足够和适宜的空间,并且能够满足仪器性能要求的温度和湿度。
3.仪器的性能验证 流式细胞仪检测的精密度、灵敏度、准确度是影响流式细胞分析的重要因素。流式细胞仪光学、液流和电子系统的元件损坏或未调试到最佳状态均可导致流式细胞分析结果出现偏差,甚至错误。为了使流式细胞分析结果准确可靠,并且各实验室间结果具有可比性,在每次使用前都应对仪器进行校准,使仪器达到标准化。实验室应有相应程序定期评估或验证所使用的方法和程序,并记录归档。内容应包括但不限于以下内容:精密度、灵敏度、准确度、生物参考区间等。该工作一般由厂商或代理商公司的工程师完成,并提供书面验证报告和校验报告。
(1)精密度:分析方法对同一样本产生重复测量相同值的能力。流式细胞仪的精密度是通过对标准颗粒检测其散射光和荧光的分布范围来描述的,通常以变异系数(CV)来说明。CV值越小,表明测量误差越小,精密度越高。理想的情况下,如果一群含量完全相等的样本,用流式细胞仪来测量,CV=0,测量曲线如下图左,但在整个系统中,会带入很多误差,使实际测量曲线结果如下图右(图5-3)。当使用荧光微球或生物活性细胞评估仪器的精密度或进行质控时,样品能发出足够数量的光子,因此可不考虑光子的统计学变异对荧光变异的影响,一般的流式细胞仪在最佳状态时,都可以达到CV<2%,满足大多数实验项目的要求。

(2)灵敏度:灵敏度的高低是衡量仪器检测微弱荧光信号的重要指标。一般以能检测到单个微球上最少标有FITC或PE荧光分子数目来表示。目前使用最为广泛的方式是流式细胞术标准化公司的MESF法。该方法所用试剂盒是由一系列标记有MESF值的微球组成(包括未标记荧光的空白微球),表明该微球所标记荧光物质的荧光强度等同于溶液中荧光染料的分子数。例如,标记有MESF值为1000的FITC微球,其荧光强度等同于1000个FITC分子。根据这一系列微球检测结果的平均荧光强度通道数进行线性回归,可得到流式细胞仪灵敏度的回归曲线,回归曲线与Y轴的交点即为该仪器的灵敏度,或称最低检测限(图5-4)。
(3)干扰试验:是指除分析物外,其他成分对分析物测量的准确度的影响。流式细胞仪中常见干扰物质为抗原抗体的非特异性结合和检测细胞或颗粒的非特异性荧光染色等。干扰试验中最好使用常规样本基质,如血清或血浆;如果加入的干扰物为液体,应尽可能减少其在样本中的体积比,可能时应控制在10%以内;为保证样本基质的一致性,原始样本中应加入不含干扰物的相同溶液,作为比对样本;对加入的物质能够实现准确定量,如称重、使用标准物质或标准液;应选择有临床意义的浓度加入基础样本,样本浓度选择3个浓度水平。一般加入的浓度接近患者样本中可能出现的最大浓度水平,所有样本应该进行双份测定。
(4)准确度:是指测定值与“真值”之间的一致性。一般可通过与参考方法比较获得,或与室间质评中同组均值比较获得。流式细胞仪的准确度同精密度和灵敏度相比不重要,这主要是由于有太多的因素可影响其准确性,其中最为重要的就是非线性问题。一个典型的例子就是DNA定量,通常G2/S期的细胞,其DNA含量应为G0/G1期细胞的2倍;但实际检测时,如果仪器进行数据处理时采用的是脉冲高度值而不是脉冲面积积分,那么检测值会略高或者略低,其原因就在于脉冲高度值与真实值之间的非线性。随着定量流式细胞技术的发展和用户对荧光定量重视程度的增加,流式细胞仪准确度的评价和质控也开始受到重视,在样品中加入内标或某些生物活性细胞,如鸡或鱼的红细胞,可以对仪器准确度进行有效监测。
(5)参考区间:由于流式细胞仪方法学、生产厂家、试剂、仪器等多因素的影响,导致各实验室间结果相差相对较大,建议实验室建立标准化的操作程序(standard operating procedures,SOPs)、质量控制和质量保证体系,在此基础上建立各种临床流式细胞免疫表型分析项目的参考区间,或选择权威文献报道的使用相同方法、相同仪器、相同人群的参考区间进行验证,合格后采用。一旦用于临床,则不宜随便改动。
4.试剂的质量保证 流式分析最基本的试剂就是抗体。所选抗体的好坏直接影响结果。影响抗体特性的因素很多,如F/P比值、压型、全长或片段、种属来源、标记荧光种类等等。而且,有CD分类号的300多种单抗和大量没有CD分类号的单抗使抗体的选择更加困难。一般,选择抗体组合遵循以下基本原则:
(1)所选的抗体组合应足够宽,可以鉴别样本中的所有细胞亚群包括正常和异常群体。
(2)对表达少的抗原应尽可能选择荧光强度强的荧光素标记。
(3)了解不同抗体的细胞反应谱以及染色模式。根据不同的实验目的选择抗体。因为相同的CD编号的抗体可能识别不同的抗原决定簇。
(4)抗体的多种组合可能相互影响与抗原的结合(如通过空间构型的阻碍),所以对所用抗体组合,应先了解每个抗体在对照细胞上单色标记的表达情况。
(5)对于临床试验尽量选择体外诊断(IVD)试剂和分析特异性(ASR)试剂,而仅供研究用(RUO)试剂一般不能用于体外诊断实验。在我国,用于体外诊断的试剂还必须取得国家食品药品监督管理局认证。这样,一个抗体组合内的抗体可能来源不同的公司,有不同的浓度、不同的亚型、不同F/P值,可能均需要自身的同型对照,而实际上,这是非常困难的。那么,尽量选择同一家公司的试剂可以减少上述的干扰。对于临床上常见的流式检测项目,所需的试剂组合基本都有参考或推荐的抗体组合。
(6)抗体的质量控制是实验的关键环节。抗体的质量包括其特异性、灵敏度、精密度。一些商业化的公司对常用单抗的检验均推出了一系列质控物,如Cyto-TroI、Immuno-Trol等。
5.校准方法 流式细胞仪的校准包括流路的稳定性、光路的稳定性、多色标记荧光颜色补偿、光电倍增管转换的线性和稳定性。对仪器的校准主要是利用标准微球进行监测。聚苯乙烯可以被做成各种大小的微球,也可被荧光标记或者拥有定量免疫球蛋白的结合位点。这种制成固定荧光强度、大小和光散射性的聚苯乙烯微球,已成为流式质控中的一个常用的标准品。流式细胞仪使用的全程质控软件,可以使日常仪器性能的质控以及质量控制评估自动完成。
 京公网安备11010102003307号
京公网安备11010102003307号

微信扫一扫
关注医隆网