近日,国家药品监督管理局发布了国家医疗器械监督抽检结果的通告(第1号)(2019年 第7号),共对5个品种130批(台)的医疗器械产品进行了质量监督抽检,其中有12批(台)产品不符合标准规定。
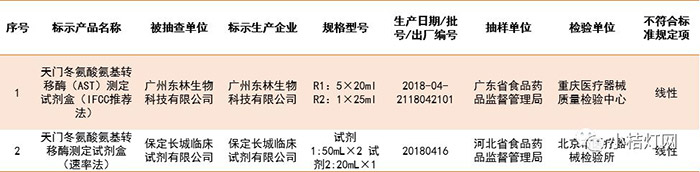
此次抽检中,IVD产品皆为天门冬氨酸氨基转移酶测定试剂盒,涉及41家企业。其中广州东林生物科技有限公司生产的1批次天门冬氨酸氨基转移酶(AST)测定试剂盒(IFCC推荐法),保定长城临床试剂有限公司生产的1批次天门冬氨酸氨基转移酶测定试剂盒(速率法),线性不符合标准规定。
具体信息如下:
抽检项目不符合标准规定的IVD产品
(点击图片放大查看)
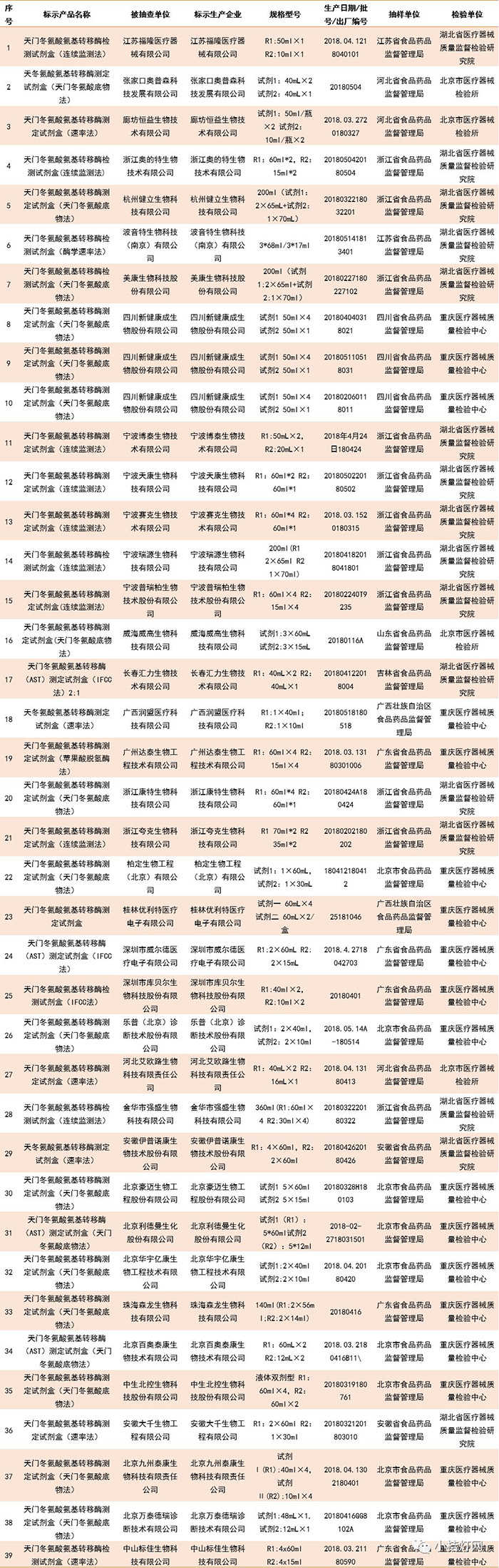
抽检项目全部符合标准规定的IVD产品
(点击图片放大查看)
对抽检中发现的不符合标准规定产品,国家药品监督管理局已要求企业所在地省级药品监督管理部门督促相关企业按照《医疗器械监督管理条例》《医疗器械召回管理办法》等法规规章要求对抽检不符合标准规定的产品进行风险评估,根据医疗器械缺陷的严重程度确定召回级别,主动召回产品并公开召回信息。同时,企业应尽快查明产品不合格原因,制定整改措施并按期整改到位,有关处置情况于2019年3月16日前向社会公布,并及时将相关情况报告至所在地省级药品监督管理部门。
企业所在地省级药品监督管理部门应对相关企业进行调查处理,对企业进行产品召回、不合格原因调查、落实整改措施及公开披露信息等情况进行监督;产品对人体造成伤害或者有证据证明可能危害人体健康的,应依法采取暂停生产、经营、使用的紧急控制措施;需要暂停进口的,应及时报国家药品监督管理局作出行政处理决定。企业未按要求落实上述要求的,所在地省级药品监督管理部门要依法严肃查处。有关信息应及时向社会公开。
以上各项落实情况,相关省级药品监督管理部门于2019年3月22日前报告国家药品监督管理局。
来源:小桔灯网 作者:面气灵
 京公网安备11010102003307号
京公网安备11010102003307号

微信扫一扫
关注医隆网